 Arrhenius definía el ácido como aquella sustancia capaz de ceder protones al medio. Un protón (H+) es un átomo de hidrógeno al que le hemos quitado el único átomo que tiene, quedándose el núcleo desnudo (y como la mayoría de los hidrógenos solo tienen en el núcleo un protón, pues se le llama al catión de hidrógeno protón). Por ejemplo:
Arrhenius definía el ácido como aquella sustancia capaz de ceder protones al medio. Un protón (H+) es un átomo de hidrógeno al que le hemos quitado el único átomo que tiene, quedándose el núcleo desnudo (y como la mayoría de los hidrógenos solo tienen en el núcleo un protón, pues se le llama al catión de hidrógeno protón). Por ejemplo:HCl → H (+) + Cl (-)
Ni esta definición de ácido es siempre válida (luego sería mejorada por Brønsted y Lewis) ni existen los protones (realmente existe H3O+, que es H2O con un H+, pero como trabajamos siempre en medio acuoso, usamos H+ para simplificar). A pesar de esto, la usaremos para explicar el concepto de "superácido".
Bien, cada ácido tiene una fortaleza, que no es más que su tendencia a ceder protones. Por ejemplo, el ácido bórico (H3BO3) es un ácido muy débil, el ácido acético (el del vinagre, CH3COOH) es un ácido débil (30000 veces más fuerte que el bórico) y el ácido sulfúrico (H2SO4) es un ácido muy fuerte.
El sulfúrico al 100 % es oxidante, deshidrante y el más fuerte de los ácidos. O al menos eso se creía, hasta que aparecieron en escena los "superácidos", ácidos más fuertes que el ácido sulfúrico al 100 %.
Algunos ejemplos:
Ácido trifluorometansulfúrico o tríflico
800 veces más fuerte que el sulfúrico

Ácido fluorosulfónico
1300 veces más fuerte que el sulfúrico

Superácido carborano
1000000 veces más fuerte que el sulfúrico
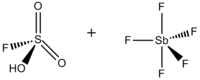
Ácido mágico (derivado del fluorosulfónico)
16000000 veces más fuerte que el sulfúrico

Ácido fluoroantimónico
2 seguido de 19 ceros más fuerte que el sulfúrico
Hay otros más exóticos, como el ión hidruro de helio. Si bien se ha conseguido reaccionar el radón, el kriptón y el xenón, no se han conseguido aún compuestos de argón, ni de neón ni mucho menos de helio.
Sin embargo, en determinadas condiciones, se puede hacer que un protón (H+) y un átomo de helio (He) reaccionen para dar HeH+. Es obvio que esto no es estable, y que el helio está como loco por deshacerse de ese protón, o sea, es un ácido estupendo. ¿Cuánto? 1 seguido de 51 ceros más fuerte que el sulfúrico.
¿PARA QUÉ SIRVEN LOS SUPERÁCIDOS?

No hay comentarios:
Publicar un comentario